コレラ毒素の免疫アジュバント活性の作用機序の解明
| 発表日時 | 2019年2月18日 10:00~10:20 |
|---|---|
| 場所 | 和歌山県立医科大学 生涯研修センター研修室(図書館棟 3階) |
| 発表者 | 医学部先端医学研究所生体調節機構研究部 助教 佐々木 泉 教授 改正 恒康 |
発表資料データダウンロード
発表内容
概要
コレラ毒素は、コレラ菌による感染症、いわゆるコレラの病因物質であるが、同時に免疫アジュバント(免疫増強剤)としても機能し、感染症やがんに対する防御免疫を増強することがわかってきている。今回、我々はコレラ毒素のBサブユニット(CTB)がマウス由来のマクロファージに作用し、炎症性サイトカインIL-1βの産生を誘導すること、そしてこのCTBの作用に、細胞内の病原体センサーNLRP3やピリンを介した炎症誘導機構が関与することを明らかにした。病原体センサーNLRP3やピリンを介したIL-1βの産生は、糖尿病や自己炎症性疾患などの病態形成にも関与する。本研究成果は、CTBの免疫アジュバント活性に基づく新しいワクチンの開発ばかりでなく、糖尿病や自己炎症性疾患の病態解明にも貢献することが期待される。
1. 背景
免疫アジュバント(免疫増強剤)は、マクロファージや樹状細胞を活性化して、炎症性サイトカインの産生を誘導し、感染症やがんに対する防御免疫を高める作用がある。リポ多糖(エンドトキシン)を認識する分子(病原体センサー)がToll様受容体4(TLR4)であること(この発見に2011年ノーベル医学生理学賞が授与されている)がわかって以来、いろんな免疫アジュバントを認識するメカニズム(病原体センサー)がわかってきた。しかし、病原体センサーがよくわかっていない免疫アジュバントも数多く存在する。
コレラ毒素(Cholera toxin:CT)は、コレラ菌により産生されるタンパク複合体であり、1個のAサブユニット(CTA)と5個のBサブユニット(CTB)から構成される。CTBは、細胞膜面上の糖脂質GM1に結合し、CTを細胞内へ誘導し、細胞内に侵入したCTAが、細胞内cAMP濃度を上昇させ、下痢などの症状を引き起こす。このようにCTは、コレラの病因物質として機能しているが、同時に、様々なT細胞応答や抗体産生を誘導するなど、免疫アジュバント活性を持つことも知られている。しかし、CTがどのようにして免疫アジュバント活性を発揮するのか、CTが免疫担当細胞によりどのように認識されているのかについてはよくわかっていない。
今回、我々は、CTBがマウス由来のマクロファージに作用し、リポ多糖と協調して炎症性サイトカインIL-1βの産生を誘導すること、そしてこの誘導に病原体センサーNLRP3やPyrin(ピリン)が関与することを明らかにしたのでここに報告する。
2. 研究手法?結果
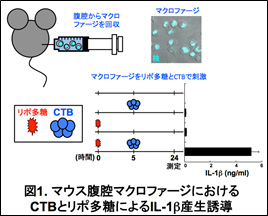 まず、CTBがマクロファージに作用するかどうか検討した。マウスの腹腔からマクロファージを回収し、CTB単独あるいはリポ多糖単独で刺激した場合には炎症性サイトカインIL-1βの産生はほとんど認められなかったが、リポ多糖で刺激後にCTBで刺激すると、顕著なIL-1β産生を認めた(図1)。すなわち、CTBはリポ多糖と協調してマクロファージに作用し、IL-1βの産生を誘導することが明らかとなった。
まず、CTBがマクロファージに作用するかどうか検討した。マウスの腹腔からマクロファージを回収し、CTB単独あるいはリポ多糖単独で刺激した場合には炎症性サイトカインIL-1βの産生はほとんど認められなかったが、リポ多糖で刺激後にCTBで刺激すると、顕著なIL-1β産生を認めた(図1)。すなわち、CTBはリポ多糖と協調してマクロファージに作用し、IL-1βの産生を誘導することが明らかとなった。
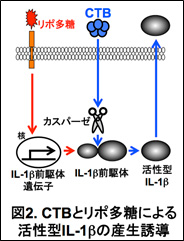 活性型IL-1βの産生には、IL-1β前駆体遺伝子の発現誘導とIL-1β前駆体のタンパク切断が必要である。CTBやリポ多糖が、活性型IL-1β産生のどのステップに必要か検討したところ、リポ多糖はIL-1β前駆体遺伝子の発現誘導に、CTBはIL-1β前駆体のタンパク切断に必要であることが明らかとなった(図2)。
活性型IL-1βの産生には、IL-1β前駆体遺伝子の発現誘導とIL-1β前駆体のタンパク切断が必要である。CTBやリポ多糖が、活性型IL-1β産生のどのステップに必要か検討したところ、リポ多糖はIL-1β前駆体遺伝子の発現誘導に、CTBはIL-1β前駆体のタンパク切断に必要であることが明らかとなった(図2)。
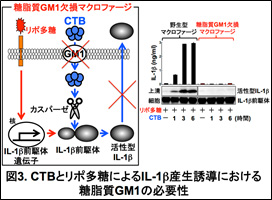 CTBは細胞膜上の糖脂質ガングリオシドGM1に結合し、細胞内に侵入する。そこで糖脂質GM1を介したCTBの細胞内侵入がIL-1βの産生に必要かどうかを、糖脂質GM1欠損マウスを用いて検討した。野生型マクロファージと比べ、糖脂質GM1欠損マクロファージでは、IL-1β前駆体のタンパクは正常に認められたが、活性型IL-1βの産生は顕著に障害されていた(図3)。このことから、糖脂質GM1を介したCTBの細胞内侵入がIL-1β産生に必要であることが明らかとなった。
CTBは細胞膜上の糖脂質ガングリオシドGM1に結合し、細胞内に侵入する。そこで糖脂質GM1を介したCTBの細胞内侵入がIL-1βの産生に必要かどうかを、糖脂質GM1欠損マウスを用いて検討した。野生型マクロファージと比べ、糖脂質GM1欠損マクロファージでは、IL-1β前駆体のタンパクは正常に認められたが、活性型IL-1βの産生は顕著に障害されていた(図3)。このことから、糖脂質GM1を介したCTBの細胞内侵入がIL-1β産生に必要であることが明らかとなった。
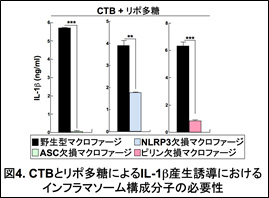 IL-1β前駆体のタンパク切断には、インフラマソームと呼ばれるタンパク複合体が必要である。インフラマソームは、病原体センサー(NLRP3やピリンなど)、タンパク切断酵素(カスパーゼ)、そしてカスパーゼと病原体センサーをつなぐアダプター分子ASCなどから構成され、病原体センサーの名前を冠してNLRP3インフラマソームやピリンインフラマソームなどと呼称される。そこで、これらのインフラマソーム構成分子を欠損するマウスを用いて、どのようなインフラマソームがCTBとリポ多糖によるIL-1β産生誘導に関与するのかを検討した(図4)。
IL-1β前駆体のタンパク切断には、インフラマソームと呼ばれるタンパク複合体が必要である。インフラマソームは、病原体センサー(NLRP3やピリンなど)、タンパク切断酵素(カスパーゼ)、そしてカスパーゼと病原体センサーをつなぐアダプター分子ASCなどから構成され、病原体センサーの名前を冠してNLRP3インフラマソームやピリンインフラマソームなどと呼称される。そこで、これらのインフラマソーム構成分子を欠損するマウスを用いて、どのようなインフラマソームがCTBとリポ多糖によるIL-1β産生誘導に関与するのかを検討した(図4)。
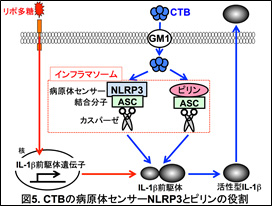 野生型マクロファージと比べ、ASC欠損、NLRP3欠損、ピリン欠損マクロファージではCTBとリポ多糖によるIL-1β産生誘導が顕著に障害された。このことから、CTBとリポ多糖によるIL-1β産生誘導には、NLRP3インフラマソームとピリンインフラマソームの両方が関与していることが明らかになった(図5)。
野生型マクロファージと比べ、ASC欠損、NLRP3欠損、ピリン欠損マクロファージではCTBとリポ多糖によるIL-1β産生誘導が顕著に障害された。このことから、CTBとリポ多糖によるIL-1β産生誘導には、NLRP3インフラマソームとピリンインフラマソームの両方が関与していることが明らかになった(図5)。
3. 波及効果
本研究により、CTBがリポ多糖と協調してマクロファージから炎症性サイトカインIL-1βの産生を誘導すること、そしてその産生誘導に細胞内の病原体センサーNLRP3やピリンを介した炎症誘導機構が関与することを明らかにした。病原体センサーNLRP3やピリンを介したIL-1βの産生は、糖尿病や自己炎症性疾患などの病態形成にも関与する。本研究により、CTBの免疫アジュバント活性に基づく新しいワクチンの開発ばかりでなく、糖尿病や自己炎症性疾患の病態解明にも貢献することが期待される。
掲載論文
2019年1月25日、国際誌International Immunology (電子版)に掲載された。
